日本批准兩項iPS細胞再生醫療產品 創全球首例
(中央社記者戴雅真東京19日專電)日本厚生勞動省專門部會今天通過決議,同意在附加條件與期限下,核發兩項使用誘導性多功能幹細胞(iPS細胞)的再生醫療產品ReHeart與Amchepry的製造販售許可。這將成為全球首批獲得藥事承認的iPS細胞產品,象徵再生醫療正式邁入實用化階段。
每日新聞、產經新聞報導,iPS細胞為可人工誘導分化為多種細胞的技術,最早在2006年由京都大學教授山中伸彌團隊成功開發,長年被視為器官修復與新藥研發的重要基礎。山中因為這項突破性研究,於2012年獲得諾貝爾醫學獎。
其中,ReHeart為心肌貼片療法,由大阪大學特任教授澤芳樹主導研究,並由東京新創公司CUORiPS推動商品化,主要用於缺血性心肌症造成的重度心衰竭患者。
治療方式為以微創手術將心肌貼片貼附於心臟表面,促進新生血管形成並修復受損組織。開發團隊表示,臨床試驗中未出現重大副作用,且已確認療效。
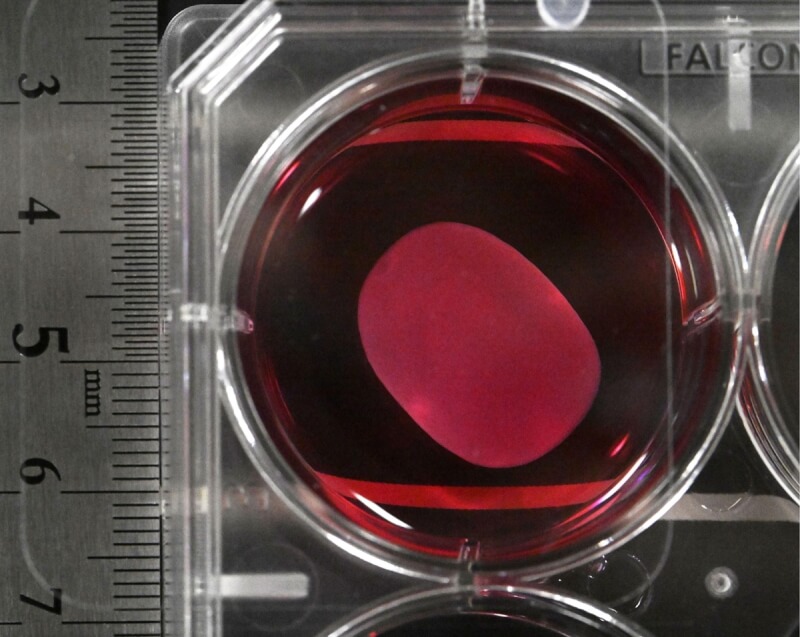
「iPS心臟」在去年舉辦的關西大阪世博曾經大放異彩。企業館PASONA NATUREVERSE由澤芳樹擔任執行製作人,館內由漫畫家手塚治虫筆下的「原子小金剛」和「怪醫黑傑克」作為導覽員,並由天才外科醫生「怪醫黑傑克」來介紹iPS心臟,參觀者可以看到由iPS細胞製造、直徑略超過3公分的迷你心臟在培養液中不斷跳動。
這次被核准的另一項產品Amchepry則鎖定進行性帕金森氏症患者,由京都大學腦神經外科教授高橋淳團隊研究,並由住友製藥與RACTHERA共同開發。該療法透過補強分泌多巴胺的神經細胞功能,改善患者運動能力。
兩項產品預計都將以「附條件、附期限承認」的方式獲准上市。這是一種為了讓患者能盡早使用創新療法而設立的制度,在確認安全性、並初步推定療效後,可先行暫時販售,但必須在規定期限內補齊有效性與安全性資料,再次申請正式承認。
兩項產品已獲藥事審議會旗下的「再生醫療等產品・生物來源技術部會」拍板,預計近期將由厚生勞動省正式核發許可。(編輯:田瑞華)1150219
本網站之文字、圖片及影音,非經授權,不得轉載、公開播送或公開傳輸及利用。