台美貿易協定簽署 先進美製藥品審查時程可望減半
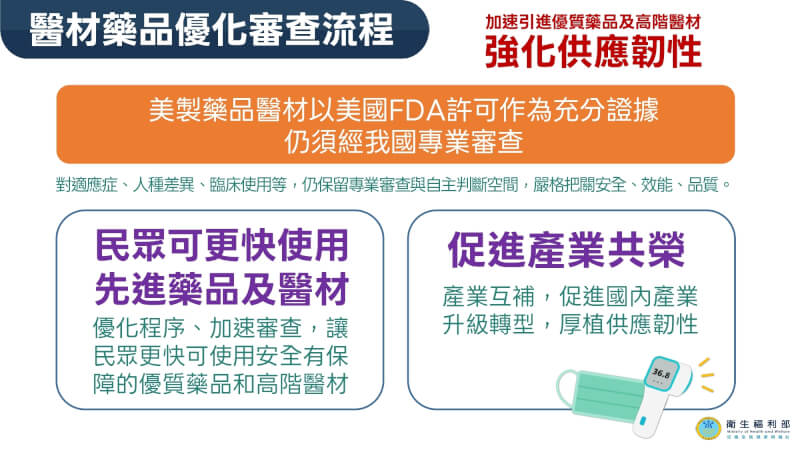
(中央社記者沈佩瑤台北13日電)台美完成對等貿易協定簽署,衛福部表示,未來取得美國上市許可的美國製造醫療器材與藥品,審查時間可望縮短一半以上,但適應症、人種差異、臨床使用等仍須通過國內專業審查。
台美對等貿易協定今天簽署,其中在醫療產業方面,通過美國食品藥物管理局(FDA)認證的醫材、藥品將獲採認,縮短審查時程,加速台美醫療體系雙向合作。
衛生福利部食品藥物管理署副署長王德原告訴中央社記者,過去美國製造的醫療器材與藥品若要申請在台上市,必須經過漫長的實質審查程序,包含從研發階段、動物試驗、三階段臨床試驗,到藥品製造與管制標準(CMC)及製造廠優良製造規範(GMP)資料等。
王德原強調,未來只要產品已獲得美國FDA核准並取得上市許可,即代表其品質、安全與療效已受美方認可。台灣方面將採信其作業程序,只要備妥相關證明文件,包括研發與製造等基礎資料,審查性質將從「實質審查」轉向類似「形式審查」,大幅簡化重複驗證流程。
不過,王德原說明,簡化流程並不代表完全免除把關。他指出,同樣藥物在不同人種之間,代謝情況、副作用及效果可能存在差異,因此針對適應症、人種差異、臨床使用等部分,仍須保留國內專業審查。
王德原解釋,審查重點將放在藥廠所提出的數據,是否足以證明對亞洲或台灣族群具備相同療效。若藥廠在美國申請時已包含亞洲人種的臨床數據,經過實質審查確認後,就不需額外要求在地臨床試驗;若數據不足,則仍會要求檢附補充資料或補做試驗。他強調,這完全取決於申請單位提供資料的完整度。
這項變革的核心在於「加速行政效率」與「保障用藥安全」之間取得平衡。王德原表示,過去新藥查驗登記需耗時360天,未來視案件性質而定,作業時間可望縮短一半以上。
學名藥協會公共事務委員會主委殷為瑩表示,若加速審查機制能制度化,不僅有助引進國際新藥,也可作為國產新藥審查的重要參考依據,提升整體審查效率,促進醫療體系、病患與產業形成正向循環。(編輯:張雅淨)1150213

- 2026/02/13 15:49
- 2026/02/13 14:26
- 2026/02/13 14:23
- 台美貿易協定簽署 先進美製藥品審查時程可望減半2026/02/13 14:17
- 2026/02/13 14:08
- 2026/02/13 14:03
本網站之文字、圖片及影音,非經授權,不得轉載、公開播送或公開傳輸及利用。
















![賴總統談國防、台美與晶片 法新專訪重點一次看[影]](https://imgcdn.cna.com.tw/www/webphotos/webcover/800/20260212/1776x1332_944729421047.jpg)



